|
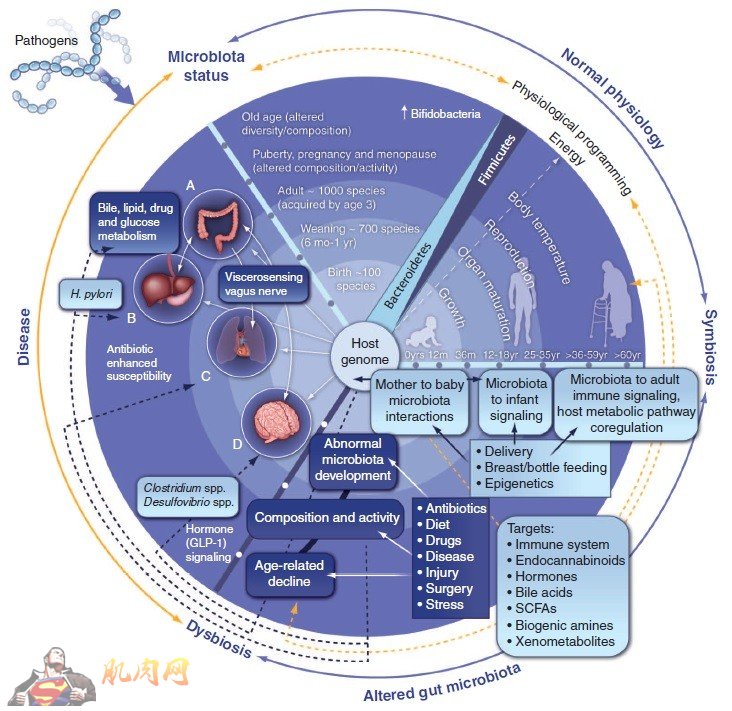
肥胖是一种常见的生理现象,其特征是脂肪在皮下组织中的积累。人体像许多动物一样有着主动贮存脂肪的倾向,应该是长期进化的产物,推测可能是用来应付饥饿和严寒吧!可是,为什么有的人很胖?有的人却很瘦?为什么女人通常比男人胖?由此我们不禁要问:肥胖是人类生存所必需的吗?这里先要打上一个大大的问号。 肥胖的标准合理吗? 通常所说的肥胖,只是一个印象,仅仅是定性,而没有量化,很难说某人是胖还是瘦,也说不清胖好还是瘦好。尽管如此,肥胖早就有标准,而且有非常具体的规定,那就是人们熟知的体质指数(BMI)。这个BMI不仅有种族差异,西方人跟东方人不同,而且还有长幼差别,成人和青少年不同!一般是以25-30公斤/平米为标准,超出此数字者就属于超重肥胖者。但是,由于脂肪组织与肌肉组织的比重不同,一个丰润的女人可能跟一个健美的男人有着同样的BMI,但前者被认为是肥胖,而后者却被认定为正常。 在一定程度上的超重(丰满、健硕)是一种正常生理现象,只有在超过某个阈值后才会呈现病理反应,而这个阈值并不能完全体现在BMI上。很多高BMI的人对胰岛素敏感。相反,很多BMI正常的人,却对胰岛素抵抗。由此可见,BMI并不能反映肥胖的健康状态,亟待建立新的肥胖定义及标准。 现在越来越多的人认识到,脂肪既可积累在皮下脂肪组织,也能沉积在内脏脂肪组织,而后者比前者对身体的危害更大。同时也认识到,褐色脂肪组织可以高效“燃烧”(分解脂肪产能),而白色脂肪组织也能转变成浅褐色脂肪组织,实质是其中的毛细血管及线粒体增加,脂肪分解代谢能力增强。 肥胖是基因决定,还是环境因素决定? 按25公斤/平米标准,美国有68%的人超重,难道美国人体内都有肥胖基因?不管肥胖的标准如何制定,脂肪的积累肯定存在个体差异,而这种差异的形成显然部分是由基因决定的,也就是肥胖有家族性遗传倾向。但是,群体性过度肥胖难以用基因变异来解释,无论是脂肪酸转运蛋白,还是脂肪酸合成酶,人与人之间的差异并不会大到让人异常超重的程度。 那么,肥胖究竟是如何引起的呢?常识告诉我们:营养摄入大于营养消耗就能导致肥胖!这话说得没错,但营养摄入过多是否仅仅是因为吃得太多和吃得太好呢?不尽然,有人“喝水也能长肉”是司空见惯的事,但很多胖子的确一直在吃,吃完主食又吃零食,他们恰恰就热衷于垃圾食品和高糖饮料。可是,很多瘦子吃得也不比别人少,但就是不见长肉,这是为什么呢? 现在已经有充分的证据表明,人发不发胖,既取决于饮食,更取决于肠道菌群,而且后者可随前者的变化而变化。简单来说,人体肠菌可分为两大类,一类是厚壁菌(俗称“肥菌”),另一类是拟杆菌(俗称“瘦菌”),前者喜高脂、高糖饮食(肉食),而后者嗜低糖、高纤维饮食(素食)。通常肥菌多于瘦菌的人就会偏肥(如欧洲人),反之则偏瘦(如亚洲人)。因此,凡是想减肥的人,只有通过改变饮食习惯来调节肠菌比例才是明智之举,单纯依赖体育锻炼并不能迅速奏效。 肥胖人体为何不能自主调节营养吸收与消耗之间的平衡? 按理说,人类经过长期进化和适应,早该形成了选择性营养吸收的机能,也就是对营养成分的吸收实行限额,但为何肠道这个消化吸收系统对于营养成分会“来者不拒”呢?而且好像是细菌分解产生多少养分,它就不加选择地吸收多少养分呢?这种现象在我看来,并不符合生命的逻辑。那么,如何解释这种不合理的现象呢? 事实上,人体对营养摄入的控制节点不在肠道吸收这个环节,而是通过更高级的神经-内分泌系统进行调节。当人饥饿时,该系统会分泌“饥饿激素”葛瑞林(ghreilin)刺激食欲,让人进食;相反,人吃饱后,则会分泌“饱腹激素”莱普汀(leptin)抑制食欲,让人禁食。因此,正常体重的人,饥饿激素与饱腹激素的分泌是有规律的,而且呈周期性变化。 可是,胖人们往往食欲很旺盛,尽管吃个不停,但却还在喊饿!所以说,胖人通过限食手段减肥会很艰难,不是他(她)没有毅力,而是从来就没有感觉吃饱过。换句话说,人体不是不能自主调节何时该进食,何时该禁食,而是肥胖者在行使激素功能上可能出了问题。 肥胖源于下丘脑炎症损伤和瘦素受体失活? 那么,胖人们在激素方面究竟出了什么问题呢?理论上,胖人的莱普汀(瘦素)似乎分泌不足或莱普汀受体敏感性可能偏低。其实,在肥胖小鼠中早就发现了瘦素抵抗(leptin resistance)现象,而在人及饲喂高脂饮食的大小鼠中也测到高瘦素血症(hyperleptinemia),这足以说明上述推测是有科学依据的。有人认为,瘦素抵抗和高瘦素血症归因于下丘脑的炎症损伤,因为瘦素受体就位于下丘脑部位。当瘦素受体功能下降后,身体不得不合成更多的瘦素,这就是形成瘦素抵抗和高瘦素血症的原因。 既然下丘脑功能失调或功能缺陷是炎症损伤的结果,那么导致炎症的根源是什么?现在有越来越多的证据表明,肠道菌群不仅促进营养的过度吸收,而且菌群失调(dysbiosis)还能同时触发慢性炎症。当某种菌群随食物变化而过度生长时,就会导致菌群失调而丧失菌群之间的相互拮抗,只得靠宿主自身的肠道粘膜免疫系统来“摆平”,从而产生较强的“免疫压力”,结果导致大量免疫细胞活化及促炎细胞因子释放,而后者可以激活诱导型一氧化氮合酶(iNOS)和促进一氧化氮迸发,并与活性氧(ROS)反应生成过氧化亚硝酸负离子(ONOO-),最终导致瘦素受体因硝基化而失活。 一般来说,肥胖导致慢性低度炎症的观点现已得到公认,但肠菌紊乱激活免疫系统引起慢性炎症并进而损伤下丘脑再诱发肥胖的说法却还不多见。然而,这个新概念却能圆满地解释为什么胖人体内会出现瘦素抵抗与瘦素血症现象。炎症反应是一把“双刃剑”,它虽能有效抑制肠菌的过度生长,但同时也造成下丘脑细胞损害,导致负责食物反馈信号的神经内分泌系统失效。这种损伤极可能包括瘦素受体失活,当然也可能涉及胰岛素受体,而后者曾得到实验证实。 综上所述,BMI并不能真正反映肥胖的健康状态,肥胖并非单纯由食物引发,而是微生物过度生长“惹的祸”,微生物菌群失调具有“双效性”,既能促进营养吸收,又能导致慢性炎症,判断“肥胖是不是病”的理想标准是看是否出现瘦素抵抗,其检测指标就是高瘦素血症。至于肥胖为何有“健康”的肥胖与“不健康”的肥胖之分,且听下回分解。 注:以上内容并非假说或推测,每个观点都有实验佐证,但描述相对简单和浅显。若有感兴趣的专业人士,可以来信索取个别相关文献,但恕不能寄送多篇文献,不便之处,敬请谅解!
主要参考文献 Nicholson JK et al. (2012) Host-Gut Microbiota Metabolic Interactions. Science 336: 1262-1267(科学网博主贾伟为共同作者) Science-2012-Nicholson-1262-7.pdf Thaler JP & Schwartz MW (2010) Inflammation and Obesity Pathogenesis: The Hypothalamus Heats Up. Endocrinology 151: 4109-4115 |
关注公众号: 健身营养 或复制ID:
foodgym
回复“营养”,即可免费获得健身饮食完整资料。










